¿Cómo se organiza la estructura atómica?
La estructura atómica es una de las bases de la química moderna. Los científicos han estado buscando entender la estructura atómica para explicar la naturaleza química de los elementos. A lo largo de los siglos, muchos científicos han desarrollado teorías para explicar cómo se organiza la estructura atómica. Estos descubrimientos han ayudado a desentrañar los secretos más profundos de la química. En este artículo, exploraremos las principales teorías que explican cómo se organiza la estructura atómica.
1. ¿Qué es la estructura atómica?
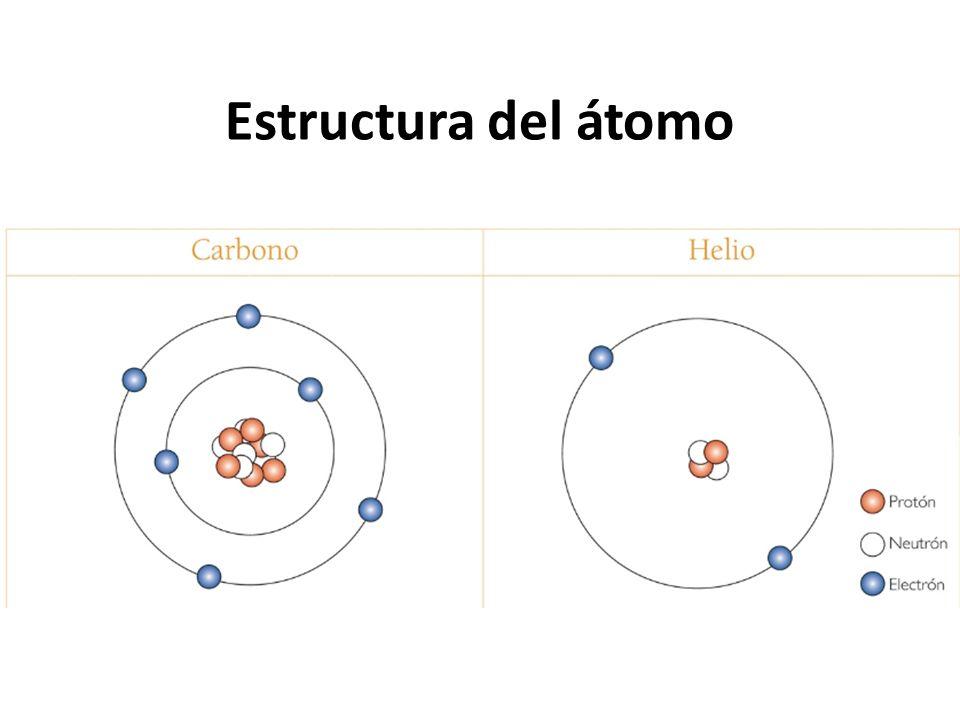
La estructura atómica es una concepción para explicar la constitución de los átomos que componen la materia. Esta estructura se describe mediante el modelo de Dalton-Lothar Meyer en el que los átomos se componen de un núcleo central (con protón y neutrones) para el que giran en el espacio electrónico alrededor eléctricamente neutral.
Los núcleos centrales de los átomos de carbono, por ejemplo, están formados por 6 protones (cuando la carga eléctrica es positiva) y 6 neutrones (cuando la carga eléctrica es neutra). Estos núcleos tienen una carga eléctrica media cero, por lo tanto no interactúan eléctricamente con los electrones exteriores, permitiendo el equilibrio del átomo.
Los electrones exteriores orbitan formando capas alrededor del núcleo en su propia órbita individual. Estas capas contienen un número determinado de electrones que se refiere al número atómico, que es el número de protones del núcleo central. Un átomo de oxígeno, por ejemplo, tendrá 8 electrones exteriores orbitando alrededor del núcleo con 8 protones. Estos electrones tienen cargas eléctricas opuestas que permiten que el átomo se quede en equilibrio.
2. La Composición Atómica
es el factor clave para entender los elementos químicos y su función en el universo. es un concepto ampliamente usado en la química para describir la estructura y el comportamiento de los materiales. Se trata de la identificación de la cantidad de cada uno de los elementos químicos en un compuesto. Para entender completamente , primero debemos conocer la estructura atómica.
Los átomos están formados por protones, neutrones y electrones. Estos componentes determinan la masa,irradiancia y radio de cada átomo. Los protones y neutrones se encuentran en el núcleo, mientras que los electrones se encuentran en los diferentes niveles energéticos que rodean al núcleo. Estas energías determinan los elementos químicos, así como sus propiedades y su comportamiento. Cada elemento químico tiene una composición única de protones, neutrones y electrones.
La cantidad de cada componente puede variar para el mismo elemento químico, dependiendo de la configuración de los orbitales electrónicos. Esta variación en la configuración electrónica se conoce como isótopos. Los isótopos se definen como isnótopos del elemento químico que tienen diferentes números de masa con el mismo número de protones. Los isótopos tienen aplicaciones prácticas como la medición de la actividad de isótopos radioactivos en el ambiente natural.
3. Los tipos de Subniveles Atómicos
Tercer Subnivel Atómico: comprende los orbitales d, f y g. Los orbitales d están formados por 5 suborbitales, dz2, dx2-y2, dxy, dxz y dyz. Estos 5 orbitales se localizan en la segunda capa de energía y los electrones que los ocupan están relacionados con los enlaces químicos.
Los orbitales f están formados por siete suborbitales asimétricos llamados f s , f x , f y , f zz , f zx , f zy , f zxx . Estos orbitales se desplazan en la tercera capa de energía de manera que los electrones que ocupan esta órbita no pueden ser empleados en enlaces químicos.
El último Subnivel Atómico se compone de los orbitales g, que están formados por nueve suborbitales no simétricos: g s , g x , g y , g xy , g x 2 - y2 , g xz , g yz , g xz2 y g xy2 . Estos suborbitales se sitúan en una cuarta capa de energía en la que los electrones no están tan restringidos para formar enlaces y su energía es mucho menor que en los subniveles anteriores.
Los electrones del último subnivel no participan en enlaces químicos, de manera que los átomos pueden ganar o perder electrones en los subniveles anteriores y no afecta a los electrones del subnivel g. Esto da libertad a los átomos para ganar o perder electrones mientras que los electrones del último subnivel permanecen en su sitio.
4. El Efecto de los Electrones en la Configuración Atómica
El comportamiento de los electrones en los átomos es fundamental para la determinación de la configuración atómica. Este comportamiento está determinado por los principios de la mecánica cuántica, lo que significa que los electrones en los átomos están sujetos a las reglas de la mecánica cuántica. La mecánica cuántica define un conjunto de reglas para la distribución de los electrones en la configuración atómica. Estos principios proporcionan criterios para la naturaleza de la energía y la configuración de los electrones en un átomo. El principio de exclusión de Pauli, la regla de Hund y la ley de cuasi-estaciones son los principios fundamentales de la mecánica cuántica.
El principio de exclusión de Pauli establece que dos electrones en un átomo no pueden tener los mismos cuatro números cuánticos. Esto significa que los electrones tienen que ocupar diferentes niveles de energía y de ahí que tengan diferentes espines. La regla de Hund establece que cuando los electrones ocupan el mismo nivel de energía, los dos electrones deben tener diferentes espines. Estas reglas cutánticas proporcionan una solidez a la configuración atómica.
La ley de cuasi-estaciones establece que los electrones de un átomo intentarán ocupar los niveles de energía más bajos para minimizar su energía. Esto significa que los electrones alcanzarán los niveles de energía más bajos para maximizar la estabilidad. Esto también significa que los electrones ocupan órbitas alrededor del núcleo atómico que ofrecen los niveles más bajos de energía para el átomo. Esto proporciona una imagen clara de por qué los elementos tienen configuraciones atómicas estables.
5. La Naturaleza de los Elementos Químicos: La Tabla Periódica
La tabla periódica es una herramienta útil para clasificar y predecir las propiedades de los elementos. Se utiliza para identificar elementos individuales, su número atómico, su masa atómica y su ubicación en la tabla. La tabla está organizada en renglones y columnas, con los elementos químicos más similares ubicados en la misma columna.
Los elementos químicos se clasifican en metal, pequeño no metal y en no metal. Los metal están ubicados a la izquierda de la tabla, mientras que los no metal se ubica en la parte derecha. Los metal son conductores de calor y electricidad, mientras que los no metal no lo son. Además, los metal tienen un brillo característico, mientras que los no metal no lo tienen.
Estos elementos se clasifican también con base en la configuración de su núcleo químico. Los elementos periódicos se clasifican en la tabla con base en su número de oxidación, ubicando los elementos con el mismo número de oxidación en la misma columna. Esta clasificación se conoce como la ley de periodicidad. Esta ley establece que los elementos con propiedades similares se encuentran en la misma columna. Por ejemplo, los elementos de la columna de enlaces metálicos, como el sodio, el potasio, el magnesio y el hierro, son metales y tienen similares capacidades conductoras y monumentos atomicos.
Los elementos se clasifican también en familias y grupos. Un elemento pertenece a una familia si está ubicado en la misma columna en la tabla. Además, los elementos se clasifican en grupos, que constan de doce columnas. En estas doce columnas se ubican elementos con propiedades similares, como magnitud de ionización y punto de fusión. Esta clasificación ayuda a entender mejor la estructura única de los elementos químicos y su lugar en la tabla.
En conclusión, conocer la naturaleza de los elementos químicos y cómo se clasifican con la tabla periódica es clave para comprender mejor la química y los elementos. La tabla nos ayuda a identificar los elementos, su número atómico, su masa atómica y a clasificarlos en familias y grupos con base en sus propiedades.
La información contenida en este artículo se ha tomado de Aquí.
6. El Movimiento de Electrones alrededor del Núcleo Atómico
es uno de los principales conceptos de la física y la química. Esencialmente, esto describe la forma en que los átomos están conectados unos con otros y los motiva a interactuar. Esta relación puede explicar muchos fenómenos, desde la conservación de energía hasta la reacción química.
Los electrones alrededor del núcleo se mueven constantemente. Estos electrones están en órbitas elípticas con energías diferentes. El movimiento de los electrones se explica en términos de diferentes estados de energía. Cuando los electrones se mueven desde un estado de energía menor a un estado de energía mayor, emiten luz. Esta es la razón por la que los metales llevan electricidad.
Los electrones también pueden moverse entre órbitas diferentes. Al moverse entre órbitas, los electrones absorben o emiten energía en forma de ondas electromagnéticas. Esto es lo que sucede cuando los átomos reaccionan unos con otros. En este proceso, se crean nuevas moléculas y compuestos que son responsables de la química básica. Los electrones también son importantes para la división celular y la propagación de señales eléctricas por los organismos.
7. El Éxito de la Configuración Atómica: Enlace Químico
El enlace químico es uno de los factores fundamentales para que la configuración atómica sea exitosa. Un enlace químico en una configuración atómica forma la unión entre dos átomos. Esta unión se crea mediante la transferencia o el compartir de electrones y es la fuerza más importante en los enlaces químicos. Los átomos se unen a través de su número de enlace para formar moléculas.
Es importante entender los principales tipos de enlaces para comprender mejor los enlaces químicos. En la naturaleza hay dos tipos principalmente, un enlace iónico y un enlace covalente. El enlace iónico se caracteriza por la transferencia de electrones entre dos átomos que resulta en la formación de una molécula con carga eléctrica. Esto se ve cuando un átomo cede electrones al otro, generando así cargas electrónicas opuestas. Por el lado contrario, el enlace covalente se caracteriza por la compartición de electrones, lo que permite a los átomos formar una unión más débil.
Para poder aprovechar la configuración atómica, es importante tener en cuenta los puntos anteriores. Se debe asegurar que los átomos estén unidos mediante un enlace químico y que se consideren los principales tipos de enlaces al implementar la configuración. Deben tenerse en cuenta las características particulares de cada enlace, como la carga y el número de electrones transferidos o compartidos entre los átomos. Después de entender los diferentes tipos de enlaces, se pueden explicar los conceptos en la configuración atómica para encontrar el éxito. Mientras que el funcionamiento de la estructura atómica es complejo, se ha demostrado que su organización y edificación puede entenderse. La estructura atómica y la forma en que está elaborada permite entender el universo de átomos y moléculas que lo rodean. A través de la investigación sobre estructura atómica, se continúa perfeccionando el conocimiento y se abren más puertas para profundizar en el estudio científico a nivel molecular.
Deja una respuesta

Sigue Leyendo